Pureza y eficacia de Mambisa, la primera vacuna nasal anticovid (I Parte)
Por Flor de Paz* / Colaboración Especial para Resumen Latinoamericano.
Noticias publicadas en distintos medios han asegurado que Mambisa, el candidato vacunal cubano que se aplica por vía nasal y el primero de su tipo en iniciar estudios clínicos en humanos en el mundo, podría cortar la trasmisión del Sars-CoV-2. ¿Cómo lo haría? ¿Será que finalmente la ciencia moderna, y específicamente este aporte de la de Cuba, conseguirá dar un golpe radical a la pandemia de la Covid-19? Sobre estas y otras interrogantes habla el Doctor en Ciencias Biológicas Gerardo Guillén Nieto, director de Investigaciones Biomédicas del Centro de Ingeniería Genética y Biotecnología (CIGB).

—Doctor Guillén, ¿qué es Mambisa?
—Un candidato vacunal que se basa en la ruta nasal como vía de inmunización, por donde el virus entra al organismo. Su principal atractivo es que una vacuna capaz de inducir una fuerte respuesta a nivel de la mucosa nasal, de la mucosa nasofaríngea, puede permitir que se evite la colonización del virus y que así disminuya la transmisión entre personas. Es decir, no sólo protege contra la severidad de la infección y la sintomatología —efectividad demostrada con las vacunas inyectables, sistémicas—, sino que también disminuye la transmisión, el contagio. Esa es su principal ventaja.
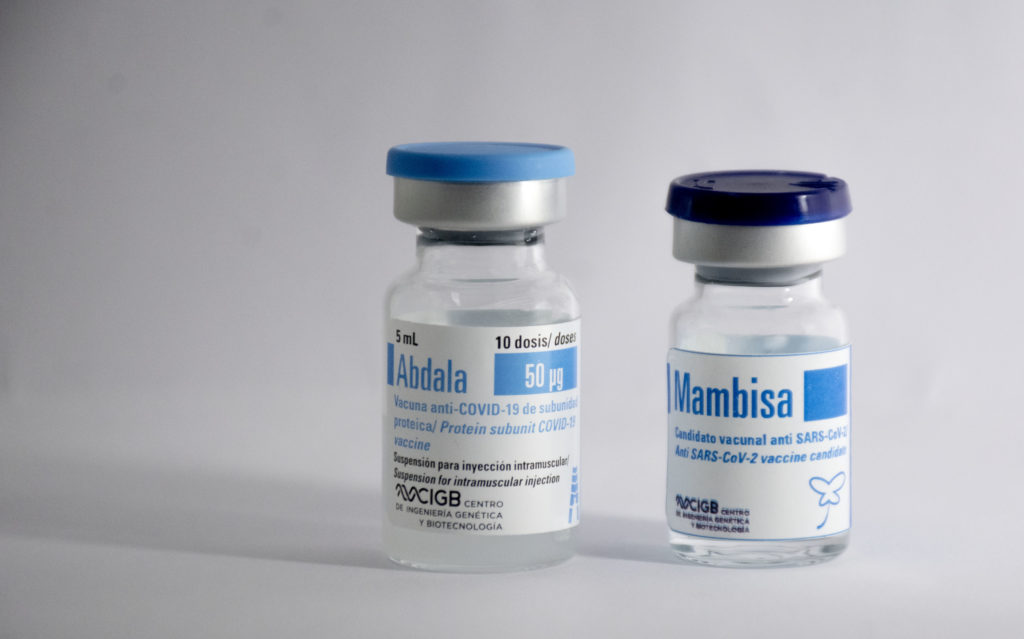
“La vacuna consiste en el mismo antígeno o componente proteico que tiene Abdala, más otra partícula de proteína recombinante obtenida por métodos biotecnológicos. A diferencia de Abdala, que se consigue mediante un proceso de fermentación en levadura, esta se logra mediante la bacteria Escherichia coli, igualmente por fermentación, y es el componente responsable de la inmunopotenciación o adyuvación o capacidad de inducir una potente respuesta inmunológica por la ruta en que se administra”.
El Doctor Guillén Nieto, comenta que esta plataforma fue desarrollada por el CIGB en el año 2015, cuando registró una vacuna que también se administra por la ruta nasal, terapéutica en este caso, contra la Hepatitis B crónica.
“Es la primera vacuna en el mundo contra una enfermedad infecciosa crónica, y la primera contra una enfermedad infecciosa crónica que se administra por la ruta nasal, cuya plataforma tecnológica utilizamos para el desarrollo de Mambisa”.
Asegura que Cuba es líder en esta tecnología, gracias a que cuenta con el mencionado adyuvante inmunopotenciador. “Incluso la revista Science en julio del año pasado reconoció que solo había siete vacunas que empleaban la ruta nasal —y el único con el método biotecnológico recombinante es Mambisa—, entre más de doscientos candidatos de vacunas contra el coronavirus que había en aquel momento en desarrollo. Los otros eran las vacunas de vectores vivos o de ARNm, que también se usan por vía inyectable. Ahora hay once candidatos vacunales que ya están en evaluación clínica, igualmente con esas diversas plataformas tecnológicas”.
Mambisa y sus estudios en fases
Los estudios clínicos con el candidato vacunal Mambisa han demostrado la seguridad del fármaco, y también que el 78 por ciento de quienes lo recibieron (no vacunados ni infectados previamente), desarrollaron respuesta a nivel de mucosa.
De acuerdo con el Doctor Guillén, Académico Titular de la Academia de Ciencias de Cuba desde 2012, en correspondencia con el avance de la vacunación y de la epidemia, el equipo científico cubano fue redireccionado el candidato vacunal Mambisa a su uso como dosis de refuerzo, “porque ya la inmensa mayoría de la población de la isla estaba vacunada, y también un por ciento había sido convaleciente (se había infectado con el Sars-CoV-2).
En sintonía con esa realidad, “estamos desarrollando dos estudios clínicos, uno de ellos —que ya está en la evaluación final de las muestras obtenidas de los dos mil doscientos veinte voluntarios—, con personas que fueron previamente vacunadas con Abdala y recibieron tres dosis de inmunización con esta vacuna y cinco meses y medio después se les puso un refuerzo con Mambisa o con Abdala, la mitad con Mambisa y la mitad con Abdala.
Y el otro, que ya está en Fase II, se basa en la aplicación de una dosis con Mambisa o con Abdala como refuerzo en individuos que han estado expuestos al virus (convalecientes) que no habían sido vacunados ni antes ni después de haberse infectado, detalló el Doctor Guillén.
“En la Fase I incluimos a ciento veinte individuos, tres grupos con Mambisa y un grupo con Abdala: treinta personas en cada grupo. Había tres grupos con Mambisa puesto que evaluamos tres dispositivos diferentes de administración nasal, y todos cumplieron con los criterios de éxito. Por lo tanto, el dispositivo que seleccionamos para continuar hacia Fase II es el que tenemos capacidad de producir en el país, a cargo del Centro de Neurociencias de Cuba.
“Ahora la Fase II la estamos desarrollando en cuatro centros clínicos a nivel nacional. Ha sido muy difícil, más compleja la inclusión de los voluntarios, y un poco más lenta porque el criterio de selección es que sean personas convalecientes que no se hayan vacunado ni antes ni después, cuando ya hay un elevado por ciento de la población en el país que ha sido vacunado”.
Para poder alcanzar un mayor número de estos voluntarios las vacunas ofrecidas para el estudio son Mambisa y Abdala sin tiomersal, lo cual ha permitido incluir a los alérgicos a esta sustancia que no habían tenido la posibilidad de vacunarse en las primeras etapas.
Esta investigación —precisa el Doctor Guillén— comprende dos grupos: el de Mambisa en la Fase I con el dispositivo que podemos producir nacionalmente, y uno de Abdala. Debe llegar a incluir poco más de mil voluntarios, estratificados en menores de sesenta (ya completo) y mayores de 60 años (faltarían unos 150 por incluir), desde 18 hasta 80 años de edad.
El científico explica, además, que en este momento se mantienen en el estudio el hospital Hermanos Ameijeiras; el policlínico Raúl Sánchez, de Pinar del Río, donde se ha trabajado muy bien en la captación de voluntarios. También el hospital Amalia Simoni, de Camagüey, y el Saturnino Lora, de Santiago de Cuba, que recibirá participantes de Granma, por ejemplo. En Camagüey han sido atendidos voluntarios de Ciego de Ávila, de Las Tunas y de Sancti Spíritus. En el Ameijeiras, de Artemisa e incluso de Matanzas”.
—Usted dijo que Mambisa es una vacuna líder ¿Se debe a que es la más avanzada?
—Sí, primero porque usamos la plataforma tecnológica de proteínas por subunidades, de proteínas recombinantes como se le llama. Son proteínas de más de un noventa y nueve por ciento de pureza, y proteínas definidas.
—¿Pureza?
— Sí. Significa que la vacuna no tiene otros contaminantes, lo que hace que sea una plataforma muy confiable, que se domina, porque ya existe desde hace más de treinta años en el CIGB. Para la vacuna de Hepatitis B que producimos (se obtuvo en el año 1991) utilizamos esta misma plataforma, y la vacuna terapéutica que mencionaba se registró en el año 2015. Es decir, se trata de una plataforma de amplio uso en el mundo, y en la práctica se ha demostrado que es muy segura. La vacuna contra la Hepatitis B se administra a los niños antes de las veinticuatro primeras horas de su nacimiento. Además, se ha demostrado ya en los estudios clínicos de Mambisa que las reacciones adversas son ligeras, no son graves, no requieren hospitalización. Todo ello facilita su avance en el aspecto regulatorio, para que se pueda registrar.
“Por otra parte, las otras vacunas que están en estudio clínico en el mundo utilizan plataformas muy novedosas, plataformas de ARNm, de virus vivos, con las que se requiere cuidado en los aspectos de seguridad.
“Estas mismas plataformas utilizadas como vacunas inyectables tienen más reacciones adversas, incluso graves; por lo tanto, hay que tener más precauciones debido a que la ruta de administración nasal tiene mayor posibilidad de provocar afectaciones neurológicas, que ha sido una de las limitaciones para el desarrollo de vacunas nasales.
“Nuestra plataforma no utiliza componentes neurotóxicos, lo cual es una ventaja para poder aspirar a que, una vez concluidos los estudios clínicos que están en curso y obtenidos los informes finales, se puedan presentar a la autoridad regulatoria y obtener el autorizo de uso de emergencia del candidato vacunal Mambisa”.
—Entonces, ¿esta tecnología desarrollada en el CIGB viabiliza el curso de Mambisa?
—La tecnología y los resultados que se están obteniendo, porque en Fase I, por ejemplo, todos los grupos evaluados cumplieron los criterios de éxito del candidato vacunal. Y en los estudios que la estamos evaluando como dosis de refuerzo también se incrementan los títulos de anticuerpos. De manera que estamos demostrando el efecto de la vacuna y su seguridad. Estos son los elementos que se evalúan para obtener el autorizo de uso de emergencia. Y en cuanto al sistema productivo, las buenas prácticas de producción, la consistencia de la producción, la estabilidad de los antígenos.
“Además, el principal componente proteico de Mambisa es el mismo que se utiliza en Abdala —que ya tiene su autorizo de uso de emergencia y que ya se produce a gran escala—, y el inmunopotenciador, el otro componente proteico, es también parte de la vacuna contra la Hepatitis registrada en 2015 y que también está aprobada”.
—Pero, ¿les faltaría hacer una Fase III?
—No, en este caso no hay Fase III porque la Fase III implicaría tener un grupo-control no inmunizado o con placebo, y ese grupo-control es imposible una vez que toda la población del país está vacunada.
“Encima, estamos hablando de una indicación como dosis de refuerzo. No puede haber un control en ese sentido. Se trata de demostrar su seguridad y que alcanza el objetivo de incrementar la respuesta inmunológica (es decir, tanto el título de anticuerpos como la capacidad funcional de esos anticuerpos) y esto se consigue con un Fase II, que incluye a más de dos mil voluntarios en uno de los estudios mencionados anteriormente y a más de mil en el otro”.
Al respecto, el Doctor Guillén Nieto, Miembro Titular de la Sociedad Cubana de Inmunología desde 1996 y Miembro de Honor desde 2012, explicó que la clasificación de estudio Fase I, II, III, aunque se sigue usando porque es muy gráfica, es arcaica.
“Los estudios clínicos ya no pueden delimitarse tan drásticamente; los hay, por ejemplo, de prueba de concepto, de evaluación inicial, clínicos de seguridad y de indicios de respuesta, de efectividad. Sin embargo, esa efectividad se evalúa de diferentes formas. En nuestro caso, estamos hablando de estudios clínicos definitivos para obtener el registro”.
(*) Periodista cubana especializada en temas científicos y Directora de Cubaperiodistas.
Foto de portada: Cortesía CIGB.